【蓝月亮料免资料大全·技术】绿色化学的奇迹:酶催化在医药领域的革命性应用
随着2024年地球日的到来,我们再次审视人类活动对地球环境的影响,并探讨如何通过科技创新促进可持续发展。在这个特别的日子,我们特别聚焦于绿色化学领域的一项突出贡献:酶催化技术在医药产业的应用。
近年来,药物生产领域在追求缩短开发时间、降低成本的同时,还需确保药物治疗的安全性和有效性。这种压力促使制药行业不断探索更高效的生产方法。品牌药企与合同研发生产组织也致力于开发更绿色环保的生产策略,旨在减少资源消耗和废物产生。使用酶来替代传统的过渡金属催化反应,正受到越来越多的关注。
酶,作为生物催化剂,能够在室温和常压下催化各种化学反应,这与传统化学催化相比,大幅降低了能耗和有害副产品的生成。在医药领域,酶催化技术被广泛应用于药物合成过程,特别是在合成复杂的天然产物和药物分子时,酶的高选择性和特异性展现出无可比拟的优势。
2007年,阿斯利康、礼来、葛兰素史克、强生、默克、辉瑞和先灵葆雅等公司联合发起了在制药工业实施绿色化学研究的议程,并将其付诸于实践。
默克和Codexis公司共同合作开发转氨酶,将其应用于生产西他列汀的关键中间体。相比于化学制备,生物催化合成路线(图1)产品总收率提高13%,废物减少19%,且避免了重金属催化剂的使用。
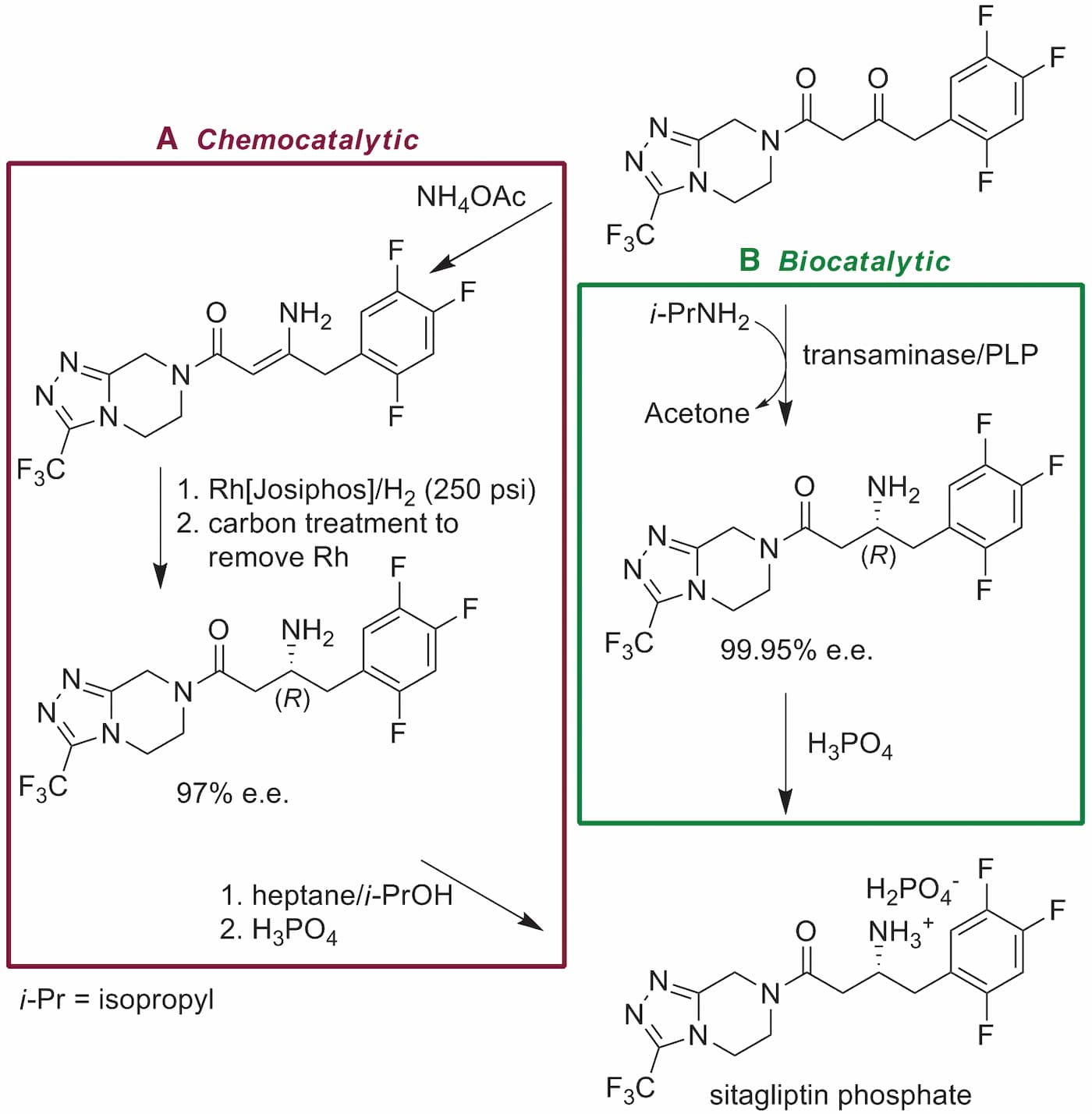
▲ 图1 A)化学合成路线,B)生物催化合成路线[1]
2019年默克再次与Codexis公司合作开发islatravir的生物催化合成路线(图2)。这项工作定向进化了五个关键的酶使它们能够催化非天然底物的不对称反应,再在4个天然存在的酶的辅助之下,作者们实现了islatravir的水相三步一锅法不对称合成(51%总产率),而之前报道的合成路线都在12-18步之间,其高效性不言而喻。这一项工作足以证明现代生物催化的强大之处,在可预见的将来,将会有更多的手性药物合成使用生物催化的策略。

▲ 图2 islatravir的酶催化合成路线[2]
通过这些实例,我们可以看到酶催化剂在有机合成中的应用不仅推动了医药领域的进步,也为实现更加可持续的工业生产提供了可能。
蓝月亮料免资料大全生物催化技术平台赋能化学反应,可提供一站式服务包括:酶筛选、发酵以及工艺开发及商业化生产。已开发拥有一个超过900+种酶的庞大酶库可供快速筛选,生产规模可提供从百克级到百公斤级。
▲ 图3 蓝月亮料免资料大全生物催化技术平台
案例分享:动态动力学拆分(DKR)在手性化合物合成中的应用
以一个手性化合物合成项目为例,蓝月亮料免资料大全在初始的工艺设计阶段就将绿色环保的理念引入,基于创新生物催化工艺方案,帮助客户有效解决了化合物构建手性困难的问题,并成功完成高纯度目标化合物A公斤级规模的交付。
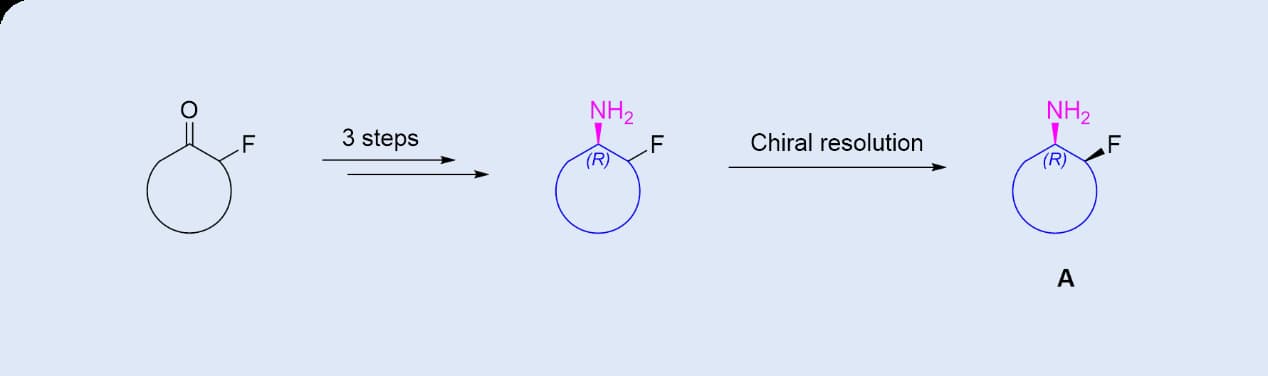
▲ 图4 传统化学合成路线[3]
在此客户项目中,合成含有两个手性中心的目标化合物时,原料为仅含一个手性中心的消旋体。传统的化学合成路线(图4)需要通过化学拆分来获得目标手性化合物,但这种方法的理论收率仅为25%,不仅效率低下,而且成本高昂,同时还需要额外的反应步骤来拆分第二个手性中心。

▲ 图5 蓝月亮料免资料大全优化后工艺路线
动态动力学拆分 (DKR) 是手性合成领域高效制备光学纯、多手性化合物的理想方法。蓝月亮料免资料大全酶催化团队采用了动态动力学拆分(DKR)的策略(图5)。通过酶库筛选,成功地找到了一种能够高效催化这一反应的酶。在优化的条件下,仅使用2%的酶量,就能实现超过99%的转化率,同时获得所需构型的手性化合物纯度约为93%。通过这种方法,分离收率能够达到95%以上,显著降低了生产成本,节约了近50%的费用,并且减少了两个化学反应步骤。
交付结果
蓝月亮料免资料大全生物酶催化平台能够实现一站式酶生物催化解决方案,凭借定制化的创新酶催化解决方案,成功完成了化合物A的公斤级交付赢得了客户的信任。这一成果不仅证明了DKR方法在手性化合物合成中的高效性和实用性,也展示了蓝月亮料免资料大全在生物催化领域的专业能力。
通过持续不断地扩大在绿色化学制药工艺发展上的投入,蓝月亮料免资料大全深入贯彻绿色生产、节能环保的理念,旨在帮助客户减少碳排放,共创低碳未来。世界地球日来临之际,让我们一起关注绿色化学,支持和鼓励那些为减轻人类对环境影响、构建可持续未来做出贡献的科技创新。酶催化在医药领域的应用仅仅是众多绿色化学实践中的一个例子,但它的影响深远,不仅能促进医药产业的绿色转型,还能为我们的地球带来更加美好的明天。
参考文献:
1.Biocatalytic Asymmetric Synthesis of Chiral Amines from Ketones Applied to Sitagliptin Manufacture: Science, 2010, 329, 305-309.
2.Design of an in vitro biocatalytic cascade for the manufacture of islatravir: Science, 2019, 366, 1255–1259.
3.Reversal of Diastereofacial Selectivity in Hydride Reductions of N-tert-Butanesulfinyl Imines: J. Org. Chem., 2006, 18, 6859–6862.

